Photonic imaging and image analysis platform at IFM
The IFM Photonic Imaging facility provides researchers with high-performance equipment and scientific expertise in photonic microscopy (confocal microscopy, video microscopy and image analysis). It provides assistance and training in photonic microscopy, image acquisition and processing.
Service offer
- Access to various microscopes and image acquisition and processing stations
- Assistance and training in image acquisition and processing
- Consulting and methodological development for image acquisition and processing
- Contribution to scientific projects involving photonic microscopy and image analysis methods
Access, booking, prices
Access conditions depend on the user’s level of training and the assistance required to use the equipment. Users must contact the manager for all new registrations.
Staff
- Theano Eirinopoulou (IR1, Inserm) Manager
- Mythili Savariradjane (AI, Sorbonne University)
Equipment





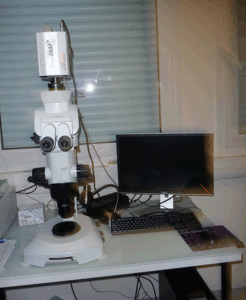
Microscope à transmission et épifluorescenceProvis (Olympus) avec caméra couleur Coolsnap.
Logiciels d’analyse d’image et reconstruction 3D: Metamorph, Huygens, Imaris.
Contact
Manager : Theano Eirinopoulou
Tel. : 01 45 87 61 72
Email : theano.eirinopoulou[@]inserm.fr


