Nedelec

Cellules souches et neurodéveloppement
Organoïdes et modèles associés pour étudier le développement humain et les maladies
Recherches
Nous étudions les bases moléculaires et cellulaires du développement humain et les maladies associées. Pour aborder ces questions nous utilisons la différenciation des cellules souches pluripotentes humaines en organoïdes ou vers des types cellulaires spécifiques couplée à des approches de transcriptomique, d’optogénétique et d’imagerie.
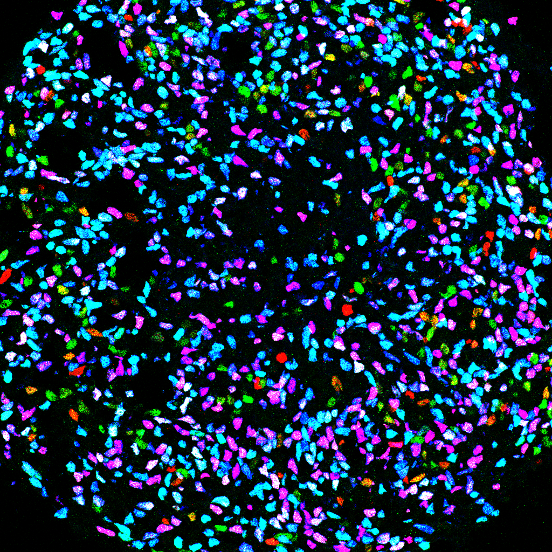

Nous cherchons à décoder les principes qui contrôlent la spécification et l’organisation de la diversité neuronale et comment les mutations génétiques perturbent ces événements conduisant à l’apparition de maladies neurodéveloppementales ou neurodégénératives. Pour aborder ces questions, nous créons des modèles in vitro d’embryogenèse humaine en contrôlant la différenciation des cellules souches pluripotentes. Ces modèles révolutionnent non seulement la façon dont nous abordons les mécanismes qui contrôlent la formation des organes et des différents types cellulaires de l’organisme, mais ils ouvrent également la voie à la production de cellules ou de tissus humains (ingénierie cellulaire et tissulaire) afin d’étudier les mécanismes sous-jacents aux maladies, pour la thérapie cellulaire ou la recherche de médicaments.
Développement humain / Ingénierie cellulaire et tissulaire
Grâce aux différenciations ciblées des cellules souches pluripotentes humaines vers des populations spécifiques de neurones, nous étudions les signaux extracellulaires et les réseaux génétiques qui assurent la formation des différents circuits neuronaux locomoteurs le long de l’axe du corps. (Projets de Célia Vaslin et Rémi Robert, voir aussi la revue Nedelec, Martinez-Arias, Cur. Op. Neuro, 2021). Nous avons préalablement inventé une nouvelle façon d’étudier le contrôle du destin cellulaire en utilisant la différenciation in vitro de cellules souches pluripotentes humaines (Maury et al. Nature Biotechnology, 2015). Sur la base de ces travaux nous avons récemment découvert des mécanismes régulant l’expression des gènes HOX. Ces découvertes nous a permis de développer les premières méthodes efficaces pour générer in vitro des sous-types de motoneurones impactés de façon différentielle dans les maladies du motoneurone (Mouilleau, Vaslin et al, Development, 2021).
Par ailleurs, en utilisant la différenciation des cellules souches en organoïdes spinaux, nous étudions le couplage entre la morphogenèse du tube neural et l’allocation spatiale de circuits neuronaux spécifiques (Duval et al, Development, 2019 et projet de Simona Gribaudo). Nous souhaitons recruter un étudiant ou un post-doc pour participer à ce projet.
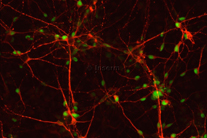
Étude de maladies neurodéveloppementales
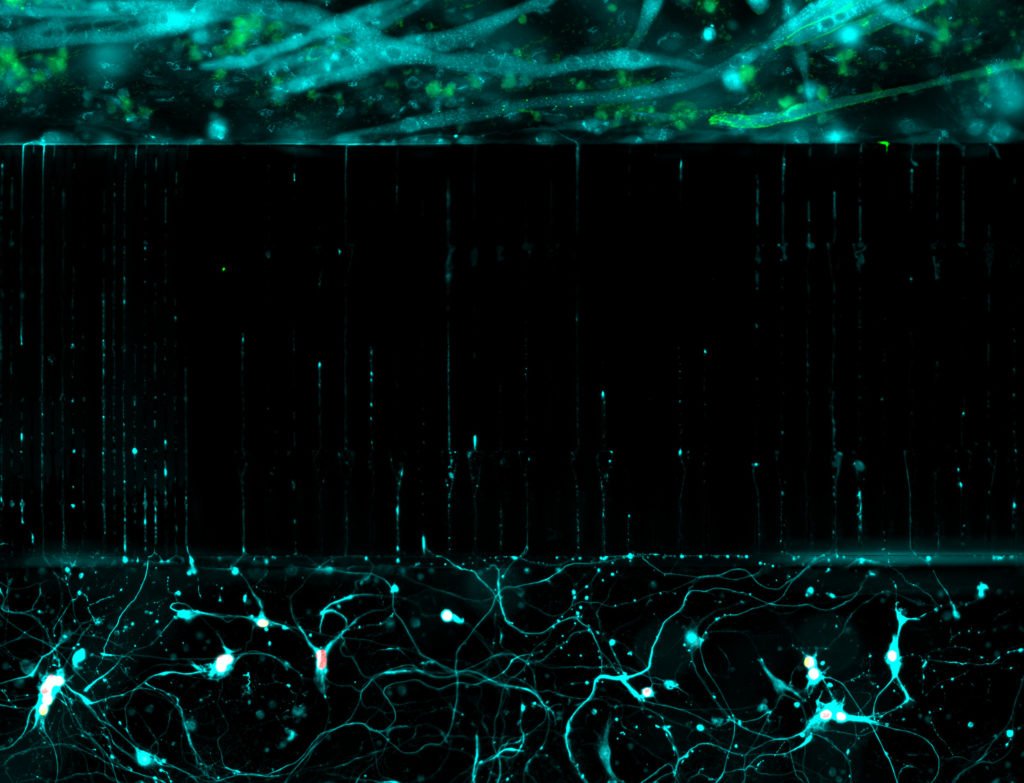
Ces modèles in vitro permettent d’accéder à des tissus ou des types cellulaires humains affecter dans des pathologies. Nous utilisons donc des cellules souches pluripotentes induites dérivées de patients et ces modèles d’embryogenèse in vitro pour étudier les bases des maladies des motoneurones, un groupe hétérogène de maladies incurables et souvent mortelles. Nous étudions en particulier les atrophies musculaires spinales (SMAs) infantiles qui, bien que provoquées par des mutations dans des gènes exprimés de manière ubiquitaire, sont liées à des défauts de formation ou de survie de populations particulières de motoneurones tandis que d’autres sont préservées. Décrypter les bases de la vulnérabilité ou de la résistance de ces différents types de motoneurones pourrait ouvrir de nouvelles pistes thérapeutiques (projet de Maeliss Calon).
Grâce à ces approches, nous commençonsun projet sur la sclérose latérale amyotrophique en collaboration avec Odil Porrua à l’IJM.
Méthodes
- Cellules souches pluripotentes humaines
- OrganoÏde
- Transcriptomique
- Optogénetique
- Imagerie
- Microfluidique
Equipe
Chef d’équipe : Stéphane NEDELEC, CRCN INSERM
- Simona Gribaudo, Ingénieure de recherche
- Rémi Robert, Etudiant en thèse. Coencadrant : J. van Helden, TAGC, Marseille
- Maeliss Calon, Etudiante en thèse. Coencadrant : A. Baffet, Institut Curie, Paris
Collaborateurs
- V. Ribes, IJM, Paris
- A. Baffet, Curie Institute, Paris
- N. Bahi-Buisson, Imagine Institute, Paris
- X. Morin, ENS, Paris
- A. Rossor, UCL, London
- E. Mazzoni, NYU, New York,
- H. Wichterle, Columbia University, New York
- M. Coppey, Curie institute, Paris
- B. Sorre, Curie institute, Paris
- C. Villard, IPGG, Paris
- O. Porrua-Fuerte, IJM, Paris
Financements
- ATIP/Avenir program – Inserm
- Association Francaise contre les Myopathies (AFM)
- Agence Nationale de la Recherche (ANR)
- Fondation pour la Recherche Médicale (FRM)
- Fondation maladies rares


